新闻动态
招生录取
2021-04-26 11:03
来源:
作者:
1.化学与生产、生活密切相关。下列说法不正确的是( )
A.利用硅材料可制成光伏发电装置 B.SO2、漂白液、双氧水的漂白原理相同
C.使用无磷洗涤剂可减少水华的发生 D.催化净化汽车尾气可降低污染
2.将等物质的量的SO2和Cl2混合后通入含有品红和BaCl2的混合溶液里,发生的现象是( )
①溶液很快褪色 ②溶液不褪色 ③有沉淀生成 ④溶液仍然透明
A.仅①和④ B.仅①和③ C.仅②和③ D.仅②和④
3.关于如右图所示装置的叙述,正确的是( )
A.锌是正极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
4.下列离子方程式正确的是( )
A.NO2通入AgNO3溶液中:3NO2+H2O===2NO3-+NO+2H+
B.过量的SO2通入NaOH溶液中:SO2+2OH-===SO+H2O
C.过量NaOH滴入NH4HCO3稀溶液中:NH+OH-===NH3·H2O
D.铜片加入稀HNO3中:Cu+2NO3-+4H+===Cu2++2NO2↑+2H2O
5.下列说法错误的是( )
A.Na2O2可用作供氧剂 B.Al2O3可用作耐火材料
C.地沟油经处理后可用作燃料油 D.盐酸属于强电解质
6.下列有机物命名正确的是( )
A. 2,4,5-三甲基-5-乙基辛烷 B. 2,5-二甲基-4-乙基己烷
C. 3-甲基-4-乙基戊烷 D. 2,3-二甲基-4-戊烯
7.下列说法错误的是( )
A.乙酸的分子模型可表示为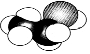
B.糖类、油脂、蛋白质都是高 分子化合物
C.乙烯使溴的四氯化碳溶液褪色是因为发生了加成反应
D.炒菜时加酒和醋能使菜味香可口,原因是有酯类物质生成
8.下列说法正确的是( )
A.C4H9Cl有4种同分异构体 B.乙醇的沸点比乙烷的沸点低
C.糖类、油脂和蛋白质都能发生水解反应 D.石油分馏可以得到丙烯等重要化工基本原料
9.下列叙述正确的是( )
A.24 g 镁与27 g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol重水与1 mol水中,中子数比为2∶1
D.1 mol乙烷和1 mol乙烯中,化学键数相同
10.苯环结构中不存在C-C单键与C=C双键的交替结构,可以作为证据的是( )
①苯不能使酸性高锰酸钾溶液褪色 ②苯在一定条件下既能发生取代反应,又能发生加成反应
③经测定,邻二甲苯只有一种结构 ④经测定,苯环上碳碳键的键长相等
A.①③④ B.①②③ C.①②③④ D.①②
11.W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是( )
A.原子半径大小为W<X<Y<Z B.X的氢化物水溶液酸性强于Z的
C.Y2W2与ZW2均含有非极性共价键 D.标准状况下W的单质状态与X的相同
12.下列实验操作,现象和结论均正确的是( )
|
|
实验操作 |
现象 |
结论 |
|
A |
稀硫酸滴入碳酸钠溶液中,将产生的气体通入盛有硅酸钠溶液的烧杯中 |
烧杯中产生白色胶状沉淀 |
非金属性:
S>C>Si |
|
B |
用铂丝蘸取少量某溶液进行焰色反应 |
火焰呈黄色 |
该溶液一定是钠盐溶液 |
|
C |
将饱和氯化铁溶液滴入盛有沸水的烧杯中,继续煮沸至溶液呈红褐色,停止加热,用激光笔照射烧杯中的液体 |
看到一条光亮的“通路” |
证明生成了氢氧化铁沉淀 |
|
D |
在分液漏斗中加入碘水后再加入CCl4,充分振荡、静置 |
分层,且上层溶液呈紫色 |
CCl4可作为碘的萃取剂 |
A.A B.B C.C D.D
13.下列有关丙烯酸(CH2=CHCOOH)的说法正确的是( )
A.丙烯酸使溴水褪色属于氧化反应
B.丙烯酸能发生加成反应但不能发生取代反应
C.丙烯酸分子中所有碳原子不可能处于同一平面
D.反应 CH2=CHCOOH + H2 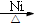 CH3CH2COOH的原子利用率为100%
CH3CH2COOH的原子利用率为100%
14.某芳香族化合物的分子式为C7H6Cl2,该有机物的可能结构有(不考虑立体异构)( )
A.9种 B.10种 C.11种 D.12种
15.金丝桃素的结构简式如图所示,下列有关它的说法正确的是( )
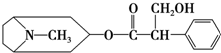
A.属于芳香烃
B.金丝桃素与酸性KMnO4溶液反应有苯甲酸生成
C.不能与金属钠发生反应
D.不能发生水解反应
16.已知 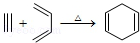 ,如果要合成
,如果要合成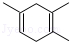 所用的原始原料可以是( )
所用的原始原料可以是( )
A.2,3﹣二甲基﹣1,3﹣丁二烯和1﹣丁炔 B.2﹣甲基﹣1,3﹣丁二烯和2﹣丁炔
C.2,3﹣二甲基﹣1,3﹣戊二烯和乙炔 D.2﹣甲基﹣1,3﹣丁二烯和丙炔
17.已知某有机物的结构简式为: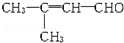 ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )
①银镜反应 ②被新制的氢氧化铜氧化 ③1mol该有机物在一定条件下和2mol氢气发生加成反应 ④能使溴水褪色 ⑤能形成高聚物 ⑥被酸性KMnO4溶液氧化.
A.①③④⑤ B.②③④⑥ C.①③⑤ D.①②③④⑤⑥
18.NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.4gC2H4、C3H6的混合气体中,所含碳原子总数为0.lNA
B.在0.1 mol/L Na2S溶液中,S2-、HS-、H2S微粒总数为0.1NA
C.标准状况下,22.4LC2H6中所含极性共价键的数目为7NA
D.50mL l2mol/L的浓盐酸与足量MnO2反应,转移电子总数为0.3NA
19.反应中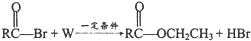 ,W为( )
,W为( )
A.CH3CHO B.CH3COOH C.CH3CH2OH D.H2O
20.下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中
和热ΔH=2×(-57.3)kJ·mol-1
B.CO的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g) ΔH=2×283.0 kJ·mol-1
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成水蒸气和二氧化碳所放出的热量是甲烷燃烧热
第Ⅱ卷
非选择题:(共5题,合计60分)
21.(7分)Ⅰ.氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。
(1)某化学课外小组查阅资料后得知2NO(g)+O2(g)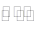 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快) ΔH1<0
N2O2(g)(快) ΔH1<0
②N2O2(g)+O2(g) 2NO2(g)(慢) ΔH2<0
2NO2(g)(慢) ΔH2<0
反应2NO(g)+O2(g) 2NO2(g)的ΔH= (用含ΔH1和ΔH2的式子表示)。
2NO2(g)的ΔH= (用含ΔH1和ΔH2的式子表示)。
决定2NO(g)+O2(g) 2NO2(g)的反应速率的是反应②,则反应①的活化能E1,与反应②的活化能E2的大小关系为E1 (填“>”“ <”或“=”)E2。
2NO2(g)的反应速率的是反应②,则反应①的活化能E1,与反应②的活化能E2的大小关系为E1 (填“>”“ <”或“=”)E2。
Ⅱ.锶(Sr)与镁是同主族元素。锶的单质及其化合物用途广泛,例如金属锶用于制造合金、光电管、照明灯,Sr(OH)2用于磨拉石的提纯,Sr(NO3)2用于烟火装置,SrCl2用于修补牙齿等。
(1)锶(Sr)位于周期表的第______周期,第______族,过氧化锶(SrO2)中锶元素的化合价为______。
(2)金属锶在常温下和水反应,有气体生成,写出该反应的化学方程式 ___________________
(3)金属锶很活泼,在空气中易被氧化,可保存在______中(填序号) 。
①水 ②酒精 ③煤油
22.(10分)从丁烷出发可合成一种香料A,其合成路线如下:

已知CH2=CH2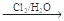 ClCH2—CH2—OH
ClCH2—CH2—OH
(1)丁烷的最简式为________________;反应②的条件为__________。
(2) X的结构简式为________________;Y的结构简式为________________。
(3)上述反应①②③④中,未涉及的反应类型是________________。(填序号)
a.氧化反应;b.还原反应;c.聚合反应;d.取代反应;e.消去反应
(4)反应⑤的化学方程式为________________________________ 。
23.(15分)近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
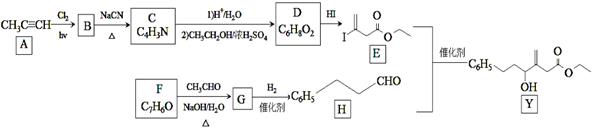
已知: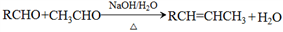
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
24.(14分)实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同
学设计下列实验以确定上述混合气体中含有乙烯和SO2。
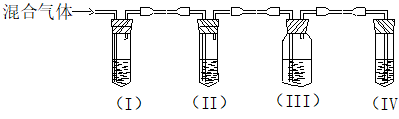
|
(1)实验室制取乙烯反应原理__________________(写出相关方程式)浓硫酸的作用是______
(2)I、II、III、IV装置可盛放的试剂是:I II III IV(请将下列有关试剂的序号填入空格内)
A、品红 B、NaOH溶液 C、浓硫酸 D、酸性KMnO4溶液
(3)能说明SO2气体存在的现象是 ;
(4)SO2能使酸性KMnO4溶液褪色,离子方程式为 ;
(5)使用装置III的目的是 ;
(6)确定含有乙烯的现象是 。
(7)制取乙烯温度宜控制在170℃左右,温度过低,如140℃则发生的副反应是________________(写出相关方程式)
25.(14分)某学习小组拟用如图所示装置来间接测定醋酸的电离热(即1 mol CH3COOH完全电离所吸收的热量),其原理如下:
[CH3COOH(l)+OH-(aq)==H2O(l)+CH3COO-(aq) ΔH′中和]-[H+(aq)+OH-(aq)===H2O(l) ΔH中和]=[CH3COOH(l)===H+(aq)+CH3COO-(aq) ΔH电离=ΔH′中和-ΔH中和)]
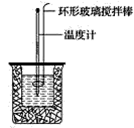
其主要过程如下:
Ⅰ.测定强酸强碱的中和热
(1)该组同学共设计出以下3种测定方案,通过测定反应过程中释放的热量来计算反应热(ΔH中和)
A.测定50 mL 0.50 mol·L-1的HCl溶液与50 mL 0.55 mol·L-1的NaOH溶液反应所放出的热量
B.测定50 mL 0.55 mol·L-1的HCl溶液与50 mL 0.50 mol·L-1的NaOH溶液反应所放出的热量
C.测定50 mL 0.55 mol·L-1的HCl溶液与50 mL 0.55 mol·L-1的NaOH溶液反应所放出的热量
请选出合理的方案________;不合理方案的原因为___________________________________。
(2)取50 mL 0.55 mol·L-1的NaOH溶液和50 mL 0.50 mol·L-1的HCl溶液进行实验,实验数据如下表:
|
实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
已知:△H =-Q/n水= -cm(t2-t1)/n水
Ⅱ.测定醋酸与NaOH溶液的反应热
该组同学设计出以下两种测定方案,通过测定反应过程中释放的热量来计算反应热(ΔH′中和)。
A.测定30 g冰醋酸与100 mL 0.55 mol·L-1的NaOH溶液反应放出的热量
B.测定0.5 moL·L-1醋酸50 mL与0.55 mol·L-1的NaOH溶液50 mL反应放出的热量
(1)合理的一组为________,理由是_______________________________________。
(2)有同学认为,用该装置测得的ΔH中和和ΔH′中和的数值在理论上均偏小,你同意不同意该观点________,原因是_______________________________________________________
(3)该同学坚持将环形玻璃搅拌棒去掉而用温度计代替,你认为可行不可行_____________。
(4)该实验中NaOH必须过量,你认为原因是________________________________________。
一.选择题
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
B |
C |
D |
A |
D |
A |
B |
A |
B |
A |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
D |
A |
D |
B |
B |
B |
D |
A |
C |
B |
二.非选择题
21.(7分,每空1分)Ⅰ. ΔH1+ΔH2 <
Ⅱ. (1)五;ⅡA;+2;
(2)Sr+2H2O=Sr(OH)2+H2↑;
(3)③;
22. (10分,每空2分)(1)C2H5 氢氧化钠的醇溶液、加热
(2)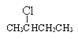
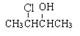
(3)b、c
(4)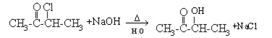
23.(15分)(1) 丙炔 (共2分)
(2)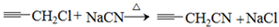 (共2分)
(共2分)
(3) 取代反应 加成反应(共2分)
(4) 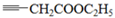 (2分)
(2分)
(5)羟基、酯基(2分)
(6)  (2分)
(2分)
(7) 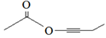 、
、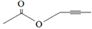 、
、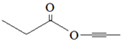 、
、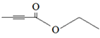 、
、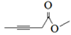 、
、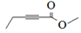 (任写3种,3分)
(任写3种,3分)
24. (14分)(1) CH3CH2OH --(浓硫酸,170℃)-->CH2=CH2↑+ H2O(2分);
催化剂和脱水剂(2分)
(2) I:A II:B III: A IV: D (2分)
(3) I中品红溶液褪色(1分)
(4) 5SO2 + 2MnO4- + 2H2O = 2 Mn2+ + 4H+ + 5SO42-(2分)
(5)证明SO2已经被完全吸收;(1分)
(6)IV中溶液颜色变浅或褪色(2分)
(7) 2CH3CH20H--(浓硫酸,140℃)-->CH3CH2-O-CH2CH3 +H2O(2分)
25. (14分)Ⅰ.(1)AB(2分)
若碱(或酸)不过量,则难以保证H+(或OH-)充分反应生成水(1分)
(2)-51.8 kJ·mol-1(2分)
Ⅱ.(1)A(1分) 因为测定的是1 mol醋酸完全电离的电离热,若用醋酸溶液,则有一部分冰醋酸已经电离,难以求算(2分)
(2)同意(1分) 原因是热量的计算是通过溶液中的温度变化来确定的,而容器、温度计、环形玻璃搅拌棒等吸收的热量都未计入(2分)
(3)不可行(1分)
(4)充分消耗H+,从而使醋酸的电离平衡向电离方向移动,充分电离(2分)
| 小初高资料领取 | 初中学习资料领取 |

扫码关注公众号:南昌新东方 回复【中考答案】,【高考答案】,【高考作文】 【计划表】领取对应资料 |

扫码关注公众号:南昌中学帮 回复【高中期末】,【中考查分】,【期末】 【均衡】领取对应资料 |
新闻动态
招生录取